Innhold
- stadier
- Metode 1 Lær regler for løselighet
- Metode 2 Bruk en mnemonic: NAG SAG
- Metode 3 Grunnleggende om læring
Løseligheten av en forbindelse er dens evne til å oppløses i vann. En uoppløselig forbindelse vil danne et bunnfall i oppløsning. En delvis løselig forbindelse sies også å være kjemisk uoppløselig. Hvis du husker reglene for løselighet, vil det gjøre livet ditt enklere når du må jobbe med kjemiske ligninger. Med litt tid, arbeid og noen mnemoniske triks, vil du huske alle formlene.
stadier
Metode 1 Lær regler for løselighet
-

Salter i gruppe 1A er oppløselige. Den periodiske tabellen over elementer er organisert i henholdsvis rader og kolonner kalt "perioder" og "grupper". Den første kolonnen i tabellen inneholder elementene i gruppe 1A. Det er alkaliske metaller. Disse inkluderer elementene Li, Na, K, Cs og Rb.- Eksempel: KCl og LiOH er løselig i vann.
-

Saltene av nitrater, klorater og acetater er løselige. Når nitrat (med formel NO3), klorat (ClO-formel3) eller lacetat (med formel CH3COO) danner salter, de blir løselige i vann.- Eksempel: KNO3NaClO3 og CH3COONa er alle løselige.
-

Alle ammoniumsalter er løselige. Ammonium løve (NH-formel4) danner salter som dissosierer fullstendig i vann. Det er ikke noe unntak fra denne regelen.- Eksempel: NH4OH er løselig selv om den inneholder en hydroksydion.
-
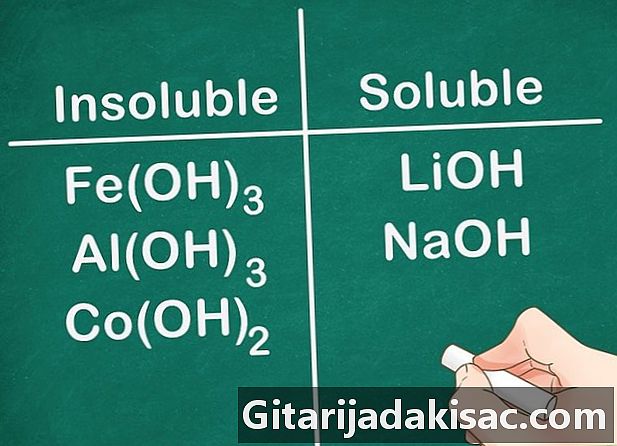
De fleste hydroksylforbindelser er uoppløselige. Noen hydroksydsalter er svakt oppløselige. Dette er tilfelle av hydroksider dannet med gruppe 2-elementer (Ca, Sr og Ba). Hydroksydsaltene dannet med gruppe 1-elementer er et unntak fordi disse elementene fremdeles er oppløselige.- Eksempel: Fe (OH)3, Al (OH)3 og Co (OH)2 er uoppløselige, men LiOH og NaOH er oppløselige.
-

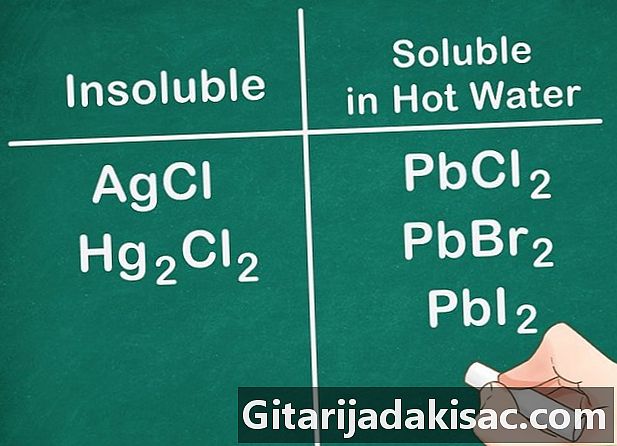
Ikke-metalliske salter i gruppe 17 er generelt løselige. Gruppe 17 ikke-metaller inkluderer klor (Cl), bromid (Br) og liode (I). Penger, bly og kvikksølv er unntak fra denne regelen. Forbindelsene som består av disse ikke-metaller og disse ionene er ikke oppløselige.- Eksempel: AgCl og Hg2cl2 er begge uoppløselige.
- PbCl2, PbBr2 og PbI2 er løselig i VELDIG VARMT vann.
-
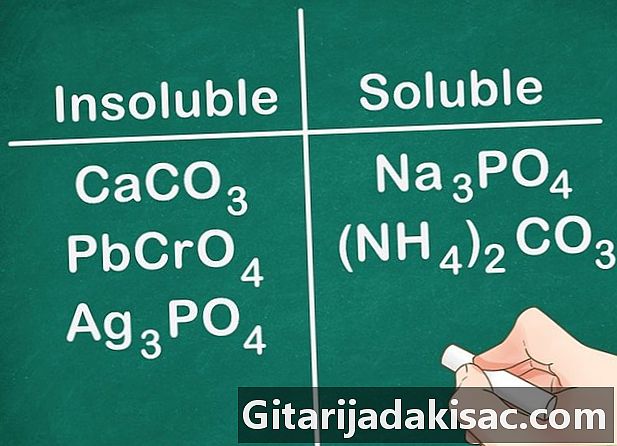
De fleste karbonater, kromater og fosfater er uoppløselige. De kjemiske formlene for disse elementene er: CO3 (karbonater), CrO4 (kromater) og PO4 (Fosfater). Gruppe 1A metaller og NH-forbindelser4 et unntak og er løselig.- Eksempel: forbindelser som CaCO3, PbCrO4 og Ag3PO4 er alle uoppløselige mens forbindelser som Na3PO4 og (NH4)2CO3 er løselig.
-
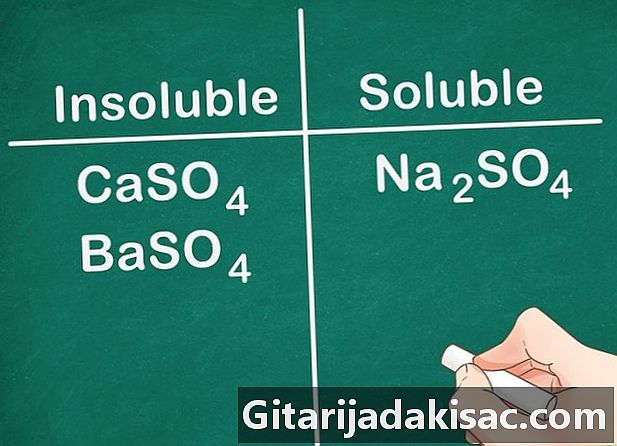
De fleste av sulfatsaltene er oppløselige. De fleste salter inkludert et SO-ion4 er løselig i vann. Ca, Ba, Pb, Ag, Sr og Hg er unntak fra denne regelen. Sulfatsaltene som inneholder disse ionene er ikke oppløselige.- Eksempel: Na2SO4 er fullstendig løselig mens CaSO4 og BaSO4 er ikke løselig.
-

De fleste svovelforbindelser er uoppløselige i vann. Barium, kalsium, magnesium, natrium, kalium og ammonium er unntak fra denne regelen. Bare forbindelser laget av disse elementene og sulfid er løselig i vann.- Eksempel: CdS, FeS og ZnS er alle uoppløselige.
- Imidlertid er overgangsmetallsulfider uoppløselige.
Metode 2 Bruk en mnemonic: NAG SAG
-

Bruk den mnemoniske NAG SAG-mnemonikken. Lacronyme NAG SAG er et enkelt triks for å huske oppløselige forbindelser og unntak. Skriv navnet NAG SAG og husk betydningen av hver bokstav. Denne teknikken utelukker ikke alle oppløselighetsregler, men dekker en god del av dem. Alle bokstavene representerer oppløselige molekyler.- N: Nitrater (NO3)
- A: Acetater (CH3COO)
- G: Alkalimetallgrupper 1 (Li, Na, etc.)
- S: Sulfater (SO4)
- A: Ammoniumioner (NH4)
- G: ikke-metaller fra gruppe 17 (F, Cl, Br, I, etc.)
-

Husk PMA-navnet for det første unntaket. P representerer Pb (bly). M representerer Merkur (Hg2). A representerer Silver (Ag). Disse tre ionene er aldri oppløselige med sulfatgruppen eller ikke-metaller fra gruppe 17.- Når du legger merke til det mnemoniske trikset, tegner du en stjerne nær PMA-forkortelsen og en lignende stjerne nær S og G for SAG for å minne deg om at de er unntak.
-

Husk ordene "Castro" og "bar" for det andre unntaket. Det høres kanskje dumt ut, men disse ordene vil hjelpe deg å huske kalsiumioner (Ca, strontium (Sr) og barium (Ba).) Disse tre ionene er aldri løselig med sulfater.- Lag et kryss ved siden av disse ordene og et annet kryss nær S av SAG for å huske at disse ionene er unntakene for løseligheten av sulfat.
Metode 3 Grunnleggende om læring
-

Gjennomgå ofte. Å huske informasjon tar alltid tid og arbeid. Jo mer du leser leksjonene dine, jo mer vil du huske på lang sikt. Gå gjennom reglene ofte og test deg selv daglig.- Be venner eller familie stille spørsmål om dette emnet til lunsj eller middag.
- Oppbevar en kopi av reglene tilgjengelig for vurdering når du har litt tid.
-

Lag oversiktsark og bruk dem. Kortene er et utmerket medium for raskt å revidere et emne og huske det. Legg merke til løselighetsreglene på kort med noen eksempler. Gjennomgå arkene til du er kjent med reglene og navnene på forbindelser som er oppløselige og uoppløselige.- Ta kortene dine med deg og ta dem ut for å se i bilen eller mens du venter på vennene dine.
- Alle muligheter er gode til å se gjennom oppføringene dine.
-

Bruk mnemoniske midler. Mnemoniske verktøy er tips for å hjelpe deg å huske informasjon raskt og enkelt. Når du lærer et mnemonisk begrep, kan det være nyttig å skrive det flere ganger for å huske det. Mnemoniske triks er bare nyttige hvis du vet hva hver bokstav betyr!- Øv deg på å skrive akronymer og hva hver bokstav betyr.
- Når du er under vurdering, må du først merke mnemonic tipsene for fremtidig referanse.